Neorganinė chemija yra viena nuobodesnių chemijos sričių. Per visą ilgą Nobelio premijų istoriją už pasiekimus neorganinėje chemijoje tebuvo skirta 9 iš virš šimto premijų. O atsižvelgus į tai, kad 2007 metų premija yra susijusi su organine chemija, paskutinė premija buvo skirta 2001 metais.
Tuo įdomiau yra perskaityti, kad po 30 metų paieškų ir bandymų chemikai sugebėjo papildyti neorganinės chemijos vadovėlius nauju ryšiu – vibraciniu. Dar 1980 metais teoretikai spekuliavo, kad turėtų egzistuot naujo tipo molekulinis ryšys, kuris sujungtų du sunkius atomus trečio lengvo atomo pagalba. Tokios molekulės pavyzdys būtų du bromo atomai tarp kurių įsiterpęs vandenilio atomas.

Neorganinėje chemijoje yra žinomas keletas skirtingų ryšių. Kovalentinis ryšys sujungia atomus į molekulę, kuomet abu atomai pasidalina savo elektronais. Geriausi pavyzdžiai būtų vandenilio, deguonies, chloro molekulės.
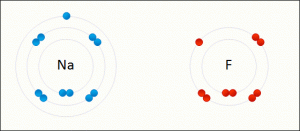
Joninis ryšys sujungia elektrostatinės sąveikos dėka dvejų medžiagų jonus. Kitaip tariant, vienas atomas „pavagia” elektroną iš antro, taip pirmas atomas tampa teigiamu jonu, o antras atomas – neigiamu jonu. Geriausias pavyzdys šio ryšio būtų valgomoji druska NaCl.

Metalinis ryšys sutinkamas metaluose, kur teigiami metalo jonai sudaro gardelę, o jų elektronai tampa bendrais visos gardelės elektronais. Kitaip tariant, metaluose negalima pasakyti, kuriam konkrečiam atomui priklauso laisvas elektronas, kadangi elektronas sąveikauja vienu metu su visos gardelės jonais. Geriausias pavyzdys būtų geležis, aliuminis, varis.

Vandenilinis ryšys sujungia ne atomus, o poliarizuotas molekules. Tai yra irgi elektrostatinis ryšys. Kadangi elektrono ryšys su protonu vandenilio molekulėje yra sąlygotinai silpnas, vandenilio atomas molekulėje lieka dažniausiai be elektrono ir turi teigiamą krūvį. Kitose molekulėse visuomet galima rast situaciją, kada koks nors atomas turi per daug elektronų, todėl tas molekulės galas turi neigiamą krūvį ir gali susijungt su kitoje molekulėje teigiamą krūvį turinčiu vandeniliu. Šis ryšys yra antras pagal silpnumą, o geriausias jo pavyzdys būtų vanduo.

Van der Valso ryšys yra giminingas vandeniliniam ryšiui, kadangi jis susieja molekules, kuriose viena molekulės dalis turi teigiamą elektrinį krūvį, o kitą molekulės dalis – neigiamą elektrinį krūvį. Tai yra silpniausias iš visų klasikinių cheminių ryšių, o jo geriausias pavyzdys būtų druskos rūgšties skystis. Van der Valso jėgų dėka kai kurie ropliai moka laipioti sienomis.
Ir štai atsirado dar vienas cheminis ryšys. Vibracinis ryšys yra įdomus tuo, kad jo potencinė energija yra didesnė, negu pavienių atomų, tačiau dėl tarp dvejų atomų vibruojančio lengvo atomo įvyksta vibracinės energijos nulio poslinkis, kompensuojantis didesnę potencinę energiją, taip lengvas tarp dvejų kitų vibruojantis atomas stabilizuoja sistemą.
Galite pasakyti, kad visa tai jau senai žinote. O kur gi naujiena? O kur gi egzotika? Kur, po galais, elementarios dalelės? Kantrybės, jos jau yra arti.

Elementarių dalelių fizikoje kiekviena dalelė turi savo antidalelę. Jei tai elektronas, tuomet jo antidalelė yra pozitronas (dar kartais vadinamas antielektronu). Jei tai yra protonas, jo antidalelė yra antiprotonas. Antidalelės turi priešingus krūvius, tačiau tą pačia masę. Kuomet dalelė sutinka savo anti porą, jos susinaikina ir dingsta, pagamindamos fotonų porą. Šis procesas vadinamas anihiliacija.

Be mums visiems įprastų elektronų, elementariųjų dalelių fizikoje egzistuoja „vyresni” elektrono broliai. Jie turi tokį pat elektrinį krūvį kaip elektronas, jų savybės labai panašios į elektrono savybes, tačiau jų masės yra didesnės. Pirmas elektrono brolis yra miuonas, jo masė yra 207 kartus didesnė negu elektrono, o pats miuonas yra nestabilus, jis skyla į elektroną, neutrino dalelės. Tauonas yra vyriausias elektrono brolis. Jis gyvena dar trumpiau nei miuonas, o jo masė yra net 3498 kartus didesnė negu elektrono masė!

Labiausiai chemijoje žinomi egzotiniai atomai yra taip vadinami izotopai. Izotopai vienas nuo kitų nesiskiria protonų skaičiumi branduolyje, tačiau jie turi skirtingus neutronų skaičius. Vandenilis turi 3 izotopus. Paprastą vandenilį, kur tėra vienas protonas, deuterį (protonas ir neutronas) bei tritį (du neutronai ir protonas branduolyje).
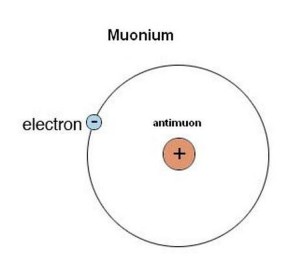

Neutronų ir protonų masė yra didelė palyginus su elektrono masė (apie 1838 kartų didesnė). Ir nors egzotiškos elementarios dalelės dažniausiai yra nestabilios, jų stabilumas išauga tuomet, kada jos sudaro egzotiškus atomus. Jei mes vandenilio atome pakeisime protoną miuonu, gausime taip vadinamą miuoniumą – egzotišką vandenilio izotopą.
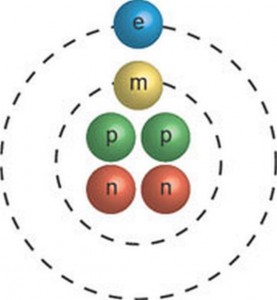
Jei pakeisime protoną antielektronu, gausime taip vadinamą pozitroniumą – kitą egzotišką vandenilio izotopą. Galima ir kita situacija, kuomet miuonas pakeičia elektroną, skriejantį apie teigiamą branduolį. Tuomet gaunami tokie egzotiški izotopai kaip miuoninis helis 4.1.
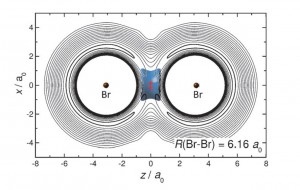
Gana ilgą laiką mokslininkai bandė rast molekulę, kurioje pasireikštų vibracinis ryšys. Ir štai atsirado potencialus kandidatas iš dvejų bromo Br atomų ir vieno vandenilio H izotopo. Berlyno Laisvo universiteto mokslininkai sugebėjo sujungt vibraciniu ryšiu du bromo atomus pasitelkę labai egzotišką vandenilio izotopą – miuoniumą Mu. Šio izotopo branduolį sudaro miuonas, kurio masė yra apie 0.1 protono masės. Dėl mažesnės branduolio masės, elektronas sukasi gerokai arčiau branduolio ir pats atomas yra gerokai lengvesnis, tad jam vibruoti tarp dvejų sunkesnių atomų yra „lengviau”.

Mokslininkai tai pat bandė išgaut šį ryšį su kitais vandenilio izotopais – deuteriu, tričiu ir vandeniliu 4.1. Pastarojo vandenilio izotopo vardas yra „sąlyginis”, kadangi, kaip minėjau, izotopo branduolys yra helio atomo branduolys, tačiau aplink branduolį sukasi ne du elektronai, o vienas elektronas ir vienas miuonas. Dėl didesnės miuono masės, jo orbitalės dydis yra gerokai mažesnis – miuonas sukasi žymiai arčiau branduolio. Dėl šios priežasties branduolį de fakto sudaro helio branduolys ir miuonas. Šie bandymai buvo nesėkmingi, kadangi vienintelis būdas stabilizuot du bromo atomus ir sunkiuos vandenilio izotopus buvo Van der Valso ryšys. Ir tik vienintelis miuonimo atomas sugebėjo sudaryt vibracinį ryšį!
Kaip matome, nors neorganinės chemijos tematika yra daugelį metų ne tokia aktuali, kaip organinė chemija, tačiau elementarių dalelių fizikos dėka ji įgauna naują postūmį. Šis naujo tipo ryšys galimai net buvo pastebėtas eksperimente, tad tai nėra vien tik teoretinė egzotika.


Ačiū už įdomią apžvalgą apie savotišką ir netradicinę chemiją 🙂
Neesminiai pastebėjimai:
* Kiek prisimenu paskaitą apie 2007 metų chemijos Nobelio premiją, tai ten neorganinių medžiagų reakcijas nagrinėjo:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2007/
* Paskui dar buvo apie kvazi-kristalus 2011, tai irgi būtų labiau neorganinė chemija, nei kokia nors kita.
* O 2005 kaip tik būtent iš organinės chemijos Nobelio premija buvo suteikta, kažkoks ten naujas sintezės metodas.
Sveiki, aš naudojau oficialią Nobelio premijų klasifikaciją, iš čia http://www.nobelprize.org/nobel_prizes/chemistry/fields.html
Kadangi ten tebuvo 9 premijos priskiriamos Inorganic Chemistry skyriui, aš pasižvalgiau po alternatyvius sąrašus. Geriausiu atveju rasdavau tik 18. Pvz čia: https://www.ionicviper.org/system/files/active/0/NobelPrizes.doc
O komentuojant apie temą, kuri neabejotinai įdomi… Atsiverčiau originalų straipsnį ir ten rašo: „This communication presents the first clear evidence for their existence, established through high-level quantum _calculations_ of …”
Tai jei kažkas teoriškai suskaičiavo, kad gali būti kažkas įdomaus, gal visgi dar niekas nepraplėtė vadovėlių, bet tik žengė pirmą mažą žingsniuką į tą pusę? Originalus straipsnis, aišku, irgi vadinasi „Fundamental change in the Nature of Chemical Bonding „, bet delfio stiliaus antraštės gal nėra sektinas pavyzdys 🙂
Na, eksperimentinis straipsnis irgi yra: Phys. Chem. Chem. Phys., 2012, 14, 10953–10966 „New results for the formation of a muoniated radical in the Mu + Br2 system: a van der Waals complex or evidence for vibrational bonding in
Br–Mu–Br?”
Ačiū už papildymą.